|
講師 : 木藤 新一郎 システム自然科学研究科 教授
日時 : 2010年11月6日(土曜日) 10:00〜16:00
会場 : 名古屋市立大学 滝子(山の畑)キャンパス
5号館2階生物実験室
はじめに
11月6日(土)の午前10時から午後4時まで、滝子キャンパス5号館2階の生物実験室で平成22年度の市民公開講座「植物の多様性をDNAで観察する」を開催しました。公開講座には、幅広い年齢層の一般市民19名に参加いただきました。はじめに植物の多様性についての講演を行い、その後、参加者に以下の実験を行ってもらうことで、実際に植物の多様性をDNAで観察してもらいました。
 (講演の様子)
(講演の様子)
実験内容とその様子
[実験1.校庭に生育している植物をサンプリングする]
まずは、参加者全員に大学にキャンパスに自生している草花や樹木からDNAを取り出すための組織をサンプリングしてもらいました。事前に、若く柔らかな葉の採取を勧めた為に多くの方が草本の葉を選ばれましたが、参加者の中にはあえて硬い樹木の葉に取り組むチャレンジ精神旺盛な人も見られました。また、同じ植物の葉と花をサンプリングして多様性を確認したいと言われる方もおり、自らの説明不足を反省した次第です。もちろん、同じ固体なら部位が異なってもDNAは同じであると説明させていただきました。
 (植物採取の風景)
(植物採取の風景)
次に、実験を行うための注意事項と実験に使用する器具の取扱方法について詳しく説明をさせていただきました。DNA実験にはマイクロピペッターと呼ばれる微量の液体を量り取るための器具が必要不可欠で、その操作次第で実験の成否が大きく左右されます。そこで、マイクロピペッターの使用については説明後に時間をかけて納得するまで練習していただきました。参加者のほぼ全員がマイクロピペッターの使用経験がありませんでしたが、皆さん普通に扱っておられ日本人の器用さを再認識しました。
 (マイクロピペッターの説明風景)
(マイクロピペッターの説明風景)
[実験2.植物からDNAを抽出する]
器具の使用になれたらいよいよ実験です。まずは、各々が取ってこられた組織からDNAを抽出してもらいました。葉を細かく切り刻み、マイクロチューブに移して抽出実験の開始です。マイクロチューブに試薬を加えて植物組織を溶かし、加温したり遠心分離することで細胞からDNAを取り出しました。人によりDNAの回収量に差はありましたが、ほとんどの参加者がマイクロチューブの底に沈んだDNA の白い沈殿を目にすることができました。
 (植物組織を細かく刻む様子)
(植物組織を細かく刻む様子)
[実験3. 抽出したDNAから特定遺伝子(trnH-psbA領域)を増幅する]
次に、回収したDNAを使用して、多型を観察するために特定の遺伝子領域をPCR法で増幅しました。増幅した領域は葉緑体DNAのtrnH-psbA領域です。通常は塩基配列の多型を調べるために利用される領域ですが、遺伝子間のスペーサー領域であるため植物種間で長さの多型が出やすいという特徴があります。その為、塩基配列を調べなくても簡単な多型観察ができます。
 (DNA実験の様子)
(DNA実験の様子)
[実験4.電気泳動でDNAを解析する]
最後に、アガロース電気泳動法で実験結果の確認を行いました。抽出したDNAと多型解析を行ったPCR増幅産物をアガロースゲルで電気泳動し、エチジウムブロマイド染色と紫外線照射でDNAを観察しました。エチジウムブロマイドは危険な試薬なため、染色後の操作は全てスタッフが行いました。図1は、参加者の実験結果の一例です。レーン1には植物細胞から抽出したDNAを泳動し、レーン2にはPCRで増幅した特定遺伝子を泳動しています。どちらも綺麗なバンドが確認でき、実験が成功したことを示しています。残念ながら、参加者全員の実験結果が同じく成功したとは言えませんが、初めてにしてはまずまずの結果だったと思います。
 (DNAサンプルの電気泳動風景)
(DNAサンプルの電気泳動風景)
 (DNAを写真撮影する様子)
(DNAを写真撮影する様子)
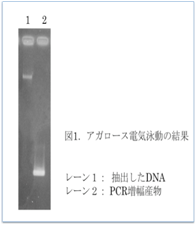 (実験結果の一例)
(実験結果の一例)
多型解析の結果
図2は、参加者数名のPCR増幅産物を泳動し、各DNAサンプル間の多型を観察した結果です。サイズの異なるDNAのバンド(多型)が見られます。サンプルCとサンプルDは同じサイズなので、同じ植物を解析した結果と思われます。参加者が採取した植物を同定していないので実験結果を議論できず、少し残念な思いをしました。
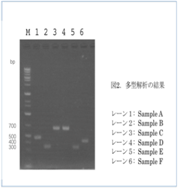 (多型解析の結果)
(多型解析の結果)
最後に
講習会の準備や当日の対応で事務の皆様に大変お世話になりました。また、実験準備や参加者への実験指導では、本学技術職員の河野良典さんにご協力いただきました。この場をかりて厚く御礼申し上げます。
(文責 木藤新一郎)
★ 今後の公開講座に関して、開催時期・テーマ・会場などのリクエストがございましたら、www-admin@nsc.nagoya-cu.ac.jpまで、お寄せください。
|  (講演の様子)
(講演の様子)
 (植物採取の風景)
(植物採取の風景)
 (マイクロピペッターの説明風景)
(マイクロピペッターの説明風景)
 (植物組織を細かく刻む様子)
(植物組織を細かく刻む様子)
 (DNA実験の様子)
(DNA実験の様子)
 (DNAサンプルの電気泳動風景)
(DNAサンプルの電気泳動風景)
 (DNAを写真撮影する様子)
(DNAを写真撮影する様子)
 (実験結果の一例)
(実験結果の一例)
 (多型解析の結果)
(多型解析の結果)
