林万柚子さん(中務研・修士1年)の論文が国際学術誌 FEMS Yeast Research に掲載されました
| 研究分野 | 生命科学(生化学) |
| 掲載誌 | FEMS Yeast Research |
| 論文題目 | Degradation of citrate synthase lacking the mitochondrial targeting sequence is inhibited in cells defective in Hsp70/Hsp40 chaperones under heat stress conditions |
| 著者 | Mayuko Hayashi, Tomoyuki Kawarasaki, and Kunio Nakatsukasa* |
| 所属機関 | 名古屋市立大学 |
| 概要 | ミトコンドリアに局在するタンパク質の大部分は、サイトゾルで標的化シグナルをもつ前駆体として合成され、ミトコンドリアへインポートされる。近年の細胞生物学的研究から、老化にともなう活性酸素の蓄積、ミトコンドリアDNAへの変異蓄積、神経変性疾患に関わる凝集タンパク質の蓄積などによりインポート反応が阻害されると、行き場を失った前駆体タンパク質がサイトゾルに蓄積することが分かってきた。サイトゾルに蓄積した前駆体タンパク質はユビキチン・プロテアソーム系を軸とした品質管理機構によって分解・除去されることが示されつつあるが、前駆体タンパク質の分解に関わる因子は十分に解明されていない。老化・疾患にともなう細胞機能障害の仕組みを解明するには、ミトコンドリアのインポート阻害に対する細胞応答を詳細に解析することが不可欠である。我々は以前、出芽酵母を用いた研究から、標的化シグナルを欠損したクエン酸合成酵素変異体(N∆Cit1)がサイトゾルでプロテアソームにより分解されることを示した。本研究では、Hsp70/Hsp40シャペロン(酵母Ssa1/Ydj1)がN∆Cit1の分解に寄与する可能性を検証した。その結果、Hsp70/Hsp40はN∆Cit1の分解に必須ではないが、熱ストレス条件においては必要であることが明らかになった。Hsp70を欠損させると、熱ストレス条件においてN∆Cit1の一部が不溶性の顆粒を形成した。ミトコンドリアのクエン酸合成酵素はサイトゾルにおいては熱ストレスに脆弱であり、その分解を促進するにはHsp70/Hsp40シャペロンの作用が必要であると考えられた。 |
| 掲載日 | 2023.12.21 |
| DOI | 10.1093/femsyr/foad054 |
| 備考 |
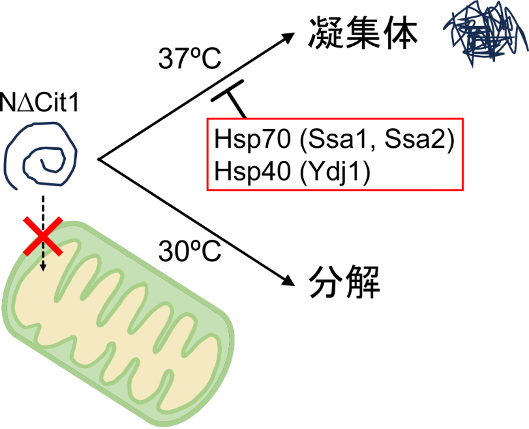
ミトコンドリア標的化シグナルを失ったクエン酸合成酵素変異体(NΔCit1)は、サイトゾルでプロテアソームにより分解される。熱ストレス条件(37℃)においては、NΔCit1の分解にHsp70/Hsp40シャペロンが必要である。